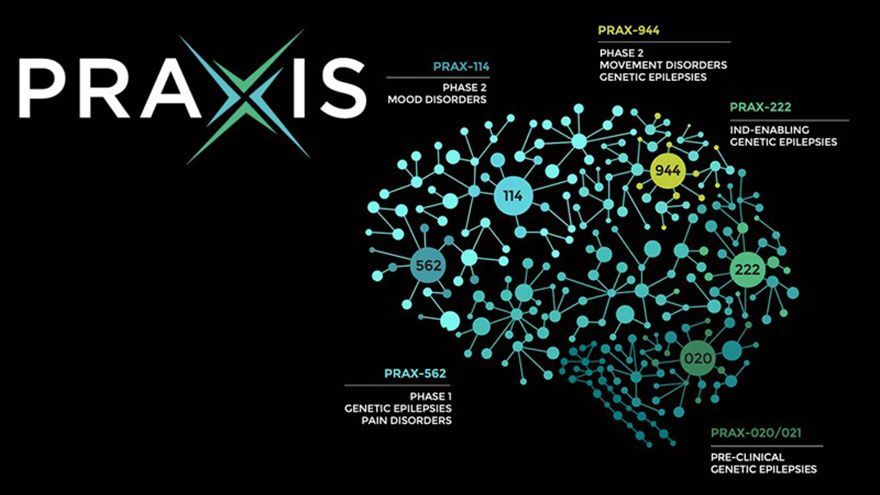
Praxis癲癇臨床二期提前結束!relutrigine療效亮眼將與FDA洽談
2025-12-08 / 記者 吳康瑋
美國時間5日,專注中樞神經療法開發的PraxisPrecisionMedicines宣布,旗下癲癇候選藥物relutrigine在臨床二期試驗EMBOLD中展現顯著療效,經獨立資料監測委員會建議提前結束收案。該試驗鎖定因SCN8A與SCN2A基因突變引起的發育性癲癇腦病變(developmentalandepilepticencephalopathies,DEE)患者,原訂2026年3月23日完成...
美FDA擬減境內早期臨床費用、課海外研發年度費
2025-12-05 / 記者 李珍伶
美國時間3日,美國食品藥物管理局(FDA)提出一項為國內藥物開發創造費用誘因的提案,減少在美國境內進行臨床開發的早期階段公司所需繳納的費用,並擬透過對未在美國進行臨床一期試驗的公司徵收較高費用,以激勵美國境內的藥物開發,進一步取代在海外進行的開發。同時,亦要求在海外進行創新研發的公司在提交新藥臨床試驗申請(IND)後,額外支付年度費用。 今(2025)年11月,以《處方藥使用者付費法案》(PDUF...
華安泡泡龍新藥啟美國臨床二期
2025-11-26 / 新聞中心
華安醫學股份有限公司(以下簡稱"華安"股票代碼:6657)今(26)日公告,自主開發的遺傳性表皮分解性水皰症(EpidermolysisBullosa,EB,俗稱「泡泡龍」)乳膏新藥F703EB,已獲美國食品藥物管理局(FDA)核准進行臨床二期試驗,將正式啟動臨床二期試驗收案,預計招募20位中重症EB患者,用以評估F703EB的初步療效及安全性,目標明年完成收案及解盲。華安表示...
御華生醫自研新藥NBM-BMX再獲孤兒藥認定 推進葡萄膜黑色素瘤開發
2025-11-24 / 新聞中心
御華生醫(NovelWisePharmaceuticalCorporation)今(24)日宣布,旗下自主研發之新一代選擇性HDAC8抑制劑NBM-BMX用於治療葡萄膜黑色素瘤(UvealMelanoma,UM),正式獲得美國食品藥物管理局(FoodandDrugAdministration,FDA)授予之孤兒藥認定(OrphanDrugDesignation,ODD)資格。此次認定緊接在御華生醫...
Arrowhead首款遺傳性高脂血症siRNA療法新藥獲FDA批准
2025-11-19 / 記者 李珍伶
美國時間18日,美國食品藥物管理局(FDA)已批准ArrowheadPharmaceuticals第一個用於治療罕見疾病家族性乳糜微粒血症(FCS)患者的小干擾RNA(siRNA)藥物Redemplo,成為美國批准的第二個FCS療法、Arrowhead的第一款獲批藥物。其是一種飲食輔助療法,目的在於降低FCS成年患者的三酸甘油酯濃度,該藥物預計於今年底前在美國上市。siRNA新藥Redemplo三...
FDA推新「合理機制」批准途徑 支持罕病患者客製化療法上市
2025-11-13 / 記者 李珍伶
美國時間12日,美國食品藥物管理局(FDA)表示,將批准少數罕見且致命性遺傳疾病的病患一項新的「合理機制途徑(plausiblemechanismpathway)」,允許FDA授予開發公司在幾名患者身上連續成功後,即可獲得上市,這項作法將使客製化基因編輯療法的開發和批准迎來巨大轉變。.FDA局長MartyMakary與醫療與科學官VinayPrasad在《新英格蘭醫學期刊》發表文章指出,對一些有明...
減重藥成美國健康重大議題!白宮協議大砍諾和諾德、禮來減重藥價
2025-11-07 / 記者 吳培安
美國時間6日,美國白宮完成與禮來(EliLilly)、諾和諾德(NovoNordisk)兩家藥廠的GLP-1受體促效劑藥品之藥價協商,根據協議結果,兩家公司將透過美國總統川普(DonaldTrump)設立的直面消費者銷售平台TrumpRx,以每月350美元的價格供應;此外,該協議還確保兩家藥廠未來推出的GLP-1減重藥,初始劑量的價格將維持在150美元左右,並首次擴大了聯邦醫療保險計畫(Medic...