向榮攜手日本New Cell Bio 進軍韓國再生醫療市場;FDA終結全民接種新冠疫苗 僅限高風險群;MS首個中東生物藥GMP工廠啟用
2025-08-28 / 編輯部
《臺灣》向榮攜手日本NewCellBio進軍韓國再生醫療市場昨(27)日,向榮生醫科技(6794)與日本NewCellBioCo.,Ltd.(NCB)簽署合作協議,攜手進軍韓國再生醫療市場,推廣幹細胞及外泌體相關產品推廣。NCB是一家以幹細胞為基礎的生物公司,總部位於東京,在韓國釜山設有分公司。NCB已與韓國高麗大學醫院建立合作關係,並獲得日本再生醫學協會的認可。而向榮生技擁有全台唯一經美國FD...
美國生物醫藥創新就快輸給中國?! FDA前局長Scott Gottlieb投書《JAMA》
2025-08-28 / 記者 吳培安
美國時間21日,美國食品藥物管理局(FDA)前局長ScottGottlieb在美國醫學會期刊《JAMA》社論平台投書指出,針對美國國家衛生院(NIH)刪減經費,以及中國藥物上市的速度益發快速,表示對於美國可能在全球生物醫藥的競爭中失去領導地位表示擔憂。 ScottGottlieb曾在川普第一屆任期中擔任FDA局長。在這篇社論中,他點出在美國國家衛生院經費刪減的同時,其他的國家正在加速他們將新藥推向...
智擎PRMT5抗癌新藥澳洲臨床一期進展;佐見啦生技7月24日登創櫃板;FDA CDER新主任出爐;Sarepta肌肉罕病基因療法臨床全叫停
2025-07-22 / 編輯部
《臺灣》智擎PRMT5抗癌新藥澳洲臨床一期獲倫委會同意 今(22)日,智擎生技製藥(4162)公告研發中癌症新藥PEP08已獲得澳洲人體試驗倫理審查委員會(HREC)同意進行臨床一期試驗,並獲得澳洲藥物管理局(TGA)備查。 智擎表示,PEP08為第二代PRMT5抑制劑,相較於第一代同類藥物,能更精準針對MTAP基因缺失之腫瘤細胞產生抑制作用,且不影響正常細胞生長,使PEP08可望比第一代PRM...
FDA批准全球首款非處方無袖帶血壓監測手環
2025-07-09 / 實習記者 康育華
美國時間8日,瑞士醫療科技公司Aktiia宣布,其開發採用光學感測器進行血壓量測的Hilo手環,獲得美國食品藥物管理局(FDA)核准,成為全球首款可在藥局販售的非處方(OTC)無袖帶血壓監測裝置,預計將於2026年在美國上市。 此次Hilo手環獲得FDA核准,突破無袖帶血壓監測技術長期難以普及的瓶頸。 Hilo手環具備持續量測血壓的功能,準確度與傳統的充氣式袖帶血壓計相當。該裝置僅需每月進行一次校...
首款遺傳性血管性水腫口服急性療法藥獲FDA批准!KalVista股價飆漲25%
2025-07-08 / 記者 李林璦
美國時間7日,KalvistaPharmaceuticals宣布,美國食品藥物管理局(FDA)正式批准EKTERLY®(sebetralstat)上市。該藥物是一款新型血漿激肽釋放酶抑制劑(plasmakallikreininhibitor),用於治療12歲及以上成人與兒童的急性遺傳性血管性水腫(HAE)發作。EKTERLY成為美國首款也是唯一獲批的口服HAE即時用藥。消息一出,KalVi...
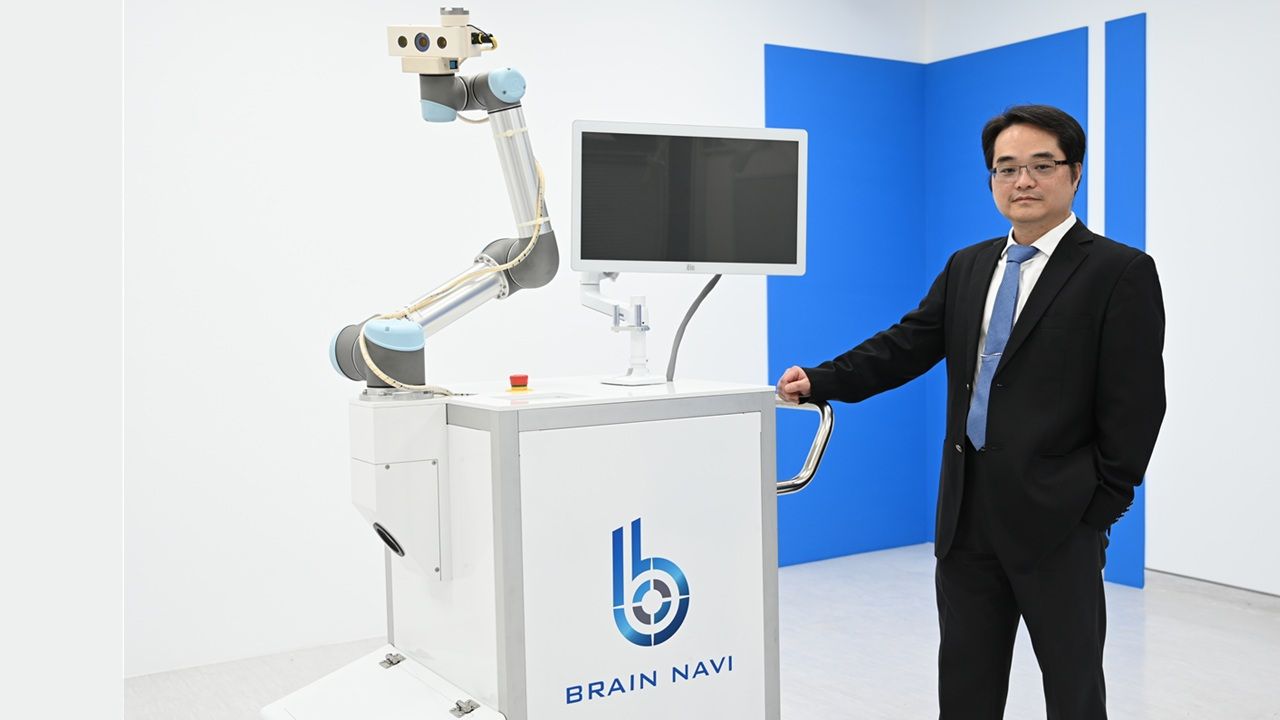
鈦隼生物科技智慧手術導航機器人NaoTrac 獲得美FDA批准!
2025-06-17 / 記者 李林璦
今(17)日,鈦隼生物科技(BrainNaviBiotechnology)宣布,旗下自主研發的腦神經導航手術機器人NaoTrac,正式取得美國食品藥物管理局(FDA)510(k)認證,產品類別為立體定位導引手術裝置(StereotaxicGuidingSurgicalDevice)。 這是鈦隼生物科技在繼通過臺灣衛生福利部(TFDA)與歐盟CE認證後,再次取得FDA核准;也是台灣第一家通過美國FD...
FDA暫停Gilead多項HIV聯合療法臨床試驗;AriBio阿茲海默新藥 6億美元授權Arcera
2025-06-11 / 編輯部
《臺灣》台寶生醫股東會通過私募案!TRK-001臨床二期、美國哈佛/梅約合作案、TDM新商模同步加速 今(11)日,台寶生醫(6892)召開股東常會,由董事長郭旭崧主持,會中承認113年營業報告書、財務報表與虧損撥補,並通過修改公司章程,以及辦理上限不超過3萬張的私募現金增資等議案。台寶生醫指出,受惠於細胞醫療設計與製造(TherapeuticsDesignandManufactruing,TDM...
思捷優達興櫃最高股價45元 YA-101臨床二期遞交日本申請;FDA推出生成式AI工具Elsa 助力審查加速新藥評估;再生元逾20億美元攜手中國翰森製藥 進軍GLP-1減重市場
2025-06-03 / 編輯部
《臺灣》思捷優達興櫃最高股價45元YA-101臨床二期遞交日本申請 美國時間2日,思捷優達-KY(7829)公告,YA-101用於治療多重系統退化症(MSA)的日本臨床二期試驗申請,已成功送交日本獨立行政法人醫藥品醫療機器綜合機構(PMDA);YA-101目前正在進行多國多中心臨床二期試驗中。 思捷優達於今(3)日以每股35元參考價登錄興櫃,開盤即衝上41.5元,最高甚至來到45元,收盤收在36...
藥品先進製造的里程碑,FDA發出第一個「先進製造技術認定」
2025-05-23 / 資策會科法所
背景近年來,國際政經局勢的變化促使全球製藥產業加速供應鏈重組。隨著醫藥技術的創新與突破,各國紛紛運用先進技術推動更具彈性與創新性的藥品生產模式,強化現有產品的製造能力,並積極推出新藥,以因應目前未被滿足的醫療需求。先進製造(AdvancedManufacturing)是新型或創新應用的醫療產品製造技術的統稱,這些技術可以提高藥品品質、解決藥品短缺問題並加快上市時間。包含連續製造(Continuou...