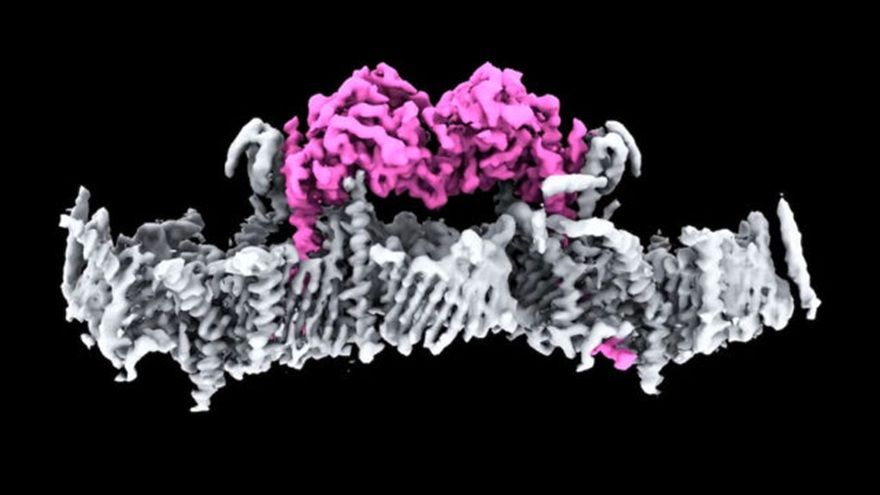
《JAMA》子刊:止咳成分Ambroxol有效延緩帕金森氏症失智進程!?
2025-07-31 / 實習記者 康育華
美國時間6月30日,聖約瑟健康照護中心(St.Joseph'sHealthCareLondon)旗下的勞森研究所(LawsonResearchInstitute)研究指出,一款在歐洲上市的止咳糖漿Ambroxol能防止帕金森氏症相關失智症惡化,甚至出現認知改善的現象,並且不會產生嚴重的副作用,研究結果已發表在《JAMANeurology》。在歐洲常見的止咳糖漿Ambroxol,已獲准用於治...
狗醫生早期診斷?!英國雙盲研究證實狗能辨認帕金森氏症體味
2025-07-17 / 實習記者 康育華
美國時間14日,英國布里斯托大學(UniversityofBristol)、曼徹斯特大學(UniversityofManchester)與醫療嗅探犬慈善機構(MedicalDetectionDogs)合作,訓練一隻黃金獵犬與一隻拉不拉多犬辨識帕金森氏症與非患者共205個皮脂拭子樣本,透過雙盲試驗證實狗的嗅覺有望成為更快速、非侵入性、普及性更高的帕金森氏症早期檢測方法。研究結果已發表在《TheJou...
《Science》揭帕金森氏症新關鍵基因!COMMD3致溶體功能障礙
2025-04-24 / 實習記者 康育華
近(10)日,美國西北大學的研究團隊利用CRISPR干擾(CRISPRinterference)技術,對人類基因體的進行研究,研究結果發現Commander基因家族的COMMD3關鍵基因缺失,會造成溶體的(lysosomal)輸送功能異常,使帕金森氏症風險提升,未來有望成為藥物研發新標靶。研究結果發表在《Science》期刊。 先前研究指出,GBA1基因的雜合性(heterozygosity)致病...
《Nature》帕金森幹細胞療法大躍進!美、日兩臨床多巴胺上升、顫抖改善
2025-04-22 / 編輯部
近(16)日,美、日兩項關於帕金森氏症幹細胞療法的早期臨床試驗結果發表,研究顯示將幹細胞衍生的神經元注入大腦被殼(putamen)不僅安全,移植的幹細胞能夠填補病患失去的多巴胺產生細胞,並產生多巴胺,部分受試者顫抖的狀況也明顯改善。兩項研究結果已發表在《Nature》期刊。 美加:人類胚胎誘導神經前驅細胞進臨床一期 第一項規模較大的研究是在美國與加拿大進行,此臨床一期試驗共納入9男3女帕金森氏症患...
帕金森氏症重大突破!《Science》首揭關鍵蛋白PINK1與粒線體結合結構
2025-03-18 / 實習記者 康育華
近(15)日,澳洲沃爾特與伊莉莎白‧霍爾研究所(WEHI)首次解開困擾科學家數十年的謎團——影響帕金森氏症相關的人類蛋白PINK1與粒線體結合的結構,以及帕金森氏症患者的突變如何影響PINK1蛋白的作用。這項研究有助帕金森氏症PINK1突變患者的新療法開發,結果已發表在《Science》期刊。粒線體是細胞內的能量工廠,在需要大量能量的細胞內,如腦細胞中,可能含有數百甚至數千...
帕金森氏症首款皮下注射穿戴裝置獲批! Supernus歷經4年半獲FDA點頭
2025-02-05 / 記者 李林璦
美國時間5日,美國食品藥物管理局(FDA)批准首個治療晚期帕金森氏症(PD)藥效波動(motorfluctuations)問題的穿戴裝置療法,該療法是由SupernusPharmaceuticals開發的多巴胺促效劑apomorphine皮下注射穿戴式裝置──SPN-830(Onapgo),在向FDA提出申請至今已經將近4年半才終於獲批准,預計在今年第二季上市。 此次批准是基於名為TOLEDO研究...