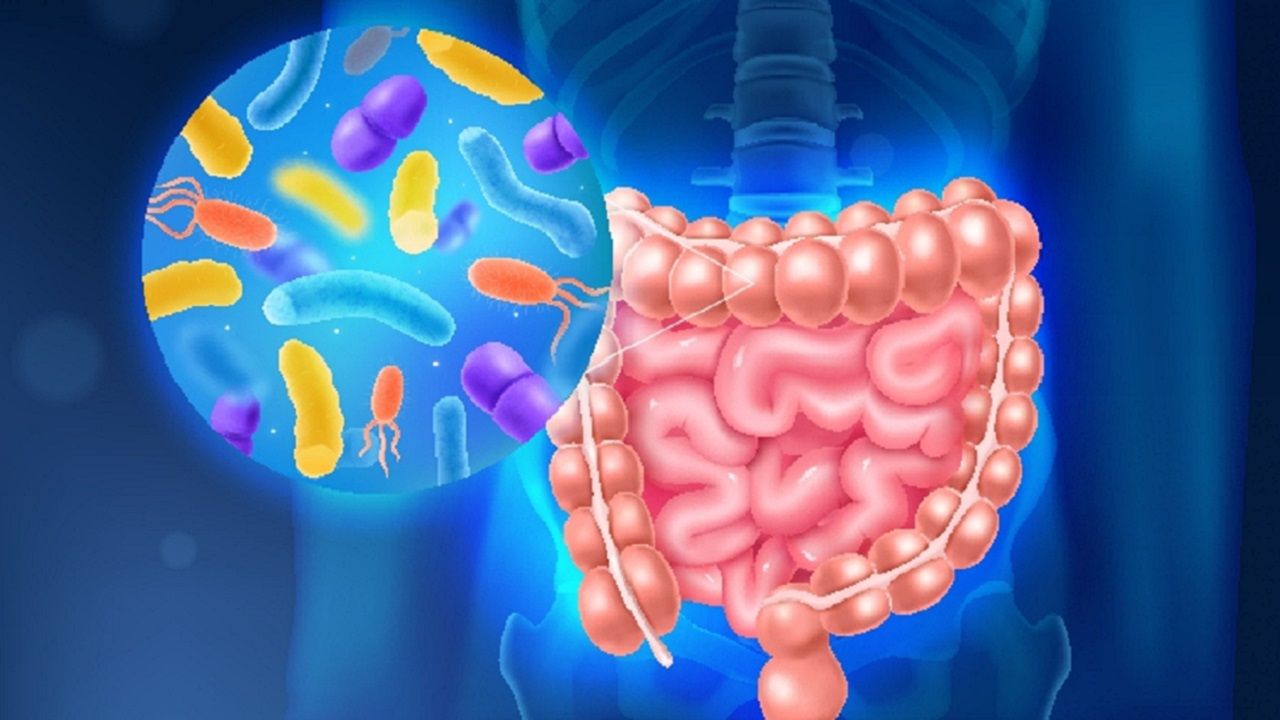
腸道菌助抗癌!《Nature》揭腸道菌H. mulieris改善小鼠PD-1抑制劑療效
2025-07-15 / 實習記者 康育華
美國時間7月14日,東京國家癌症中心(NationalCancerCenter)的免疫學家西川博嘉(HiroyoshiNishikawa)團隊,於50名癌症病患的糞便樣本分析中找出名為Hominenteromicrobiummulieris(H.mulieris)的微生物,可刺激免疫系統中的樹突細胞,進而顯著增強小鼠對PD-1免疫檢查點抑制劑(immunecheckpointinhibitors)...
逾11億美元!美時韓國子公司獲復宏漢霖PD-1抗體藥獨家權利
2025-04-28 / 記者 吳培安
近(25)日,美時(1795)宣布旗下全資子公司AlvogenKoreaCo.,Ltd.與上海復宏漢霖生技簽署獨家授權合作協議。AlvogenKorea將獲得復宏漢霖的抗PD-1單株抗體「漢斯狀」(serplulimab)在南韓市場的多項癌症適應症之獨家商業化權利,以及共同開發權利,其中包括小細胞肺癌擴散期(ES-SCLC)等適應症。 根據協議,復宏漢霖將負責該藥在韓國上市後的產品生產和供應,並將...
國衛院高齡醫學暨健康福祉研究中心上樑;美FDA首批羅氏皮下注射anti-PD-(L)1癌症療法;日本自我擴增RNA新冠疫苗 預防JN.1新版獲批
2024-09-16 / 環球生技
《臺灣》國衛院高齡醫學暨健康福祉研究中心上樑 日前(14)日,國家衛生研究院與臺大共同規畫成立的國家級「高齡醫學暨健康福祉研究中心」舉辦上樑儀式,期望透過整合跨領域的研究量能,串聯各地臨床與照護服務組織,提出具實證依據的政策建議,以完善臺灣高齡健康的相關制度。 衛福部部長邱泰源也表示,高齡研究中心未來將擔當起國家高齡及長照政策的研究以及方針的重要機構,結合臺大醫院虎尾院區二期擴建,帶給雲嘉嘉地區更...
默沙東明星PD-1抑制劑Keytruda再次受挫!一線治療轉移非鱗狀非小細胞肺癌三期失敗
2024-03-22 / 記者 李林璦
美國時間21日,默沙東(MSD)宣布,其明星PD-1抑制劑Keytruda(pembrolizumab)與阿斯特捷利康(AZ)的PARP抑制劑Lynparza(olaparib)聯合一線治療,轉移性非鱗狀非小細胞肺癌(NSCLC)患者臨床三期試驗失敗,與化療對照組相比,患者並未顯著改善總生存期(OS)和無進展生存期(PFS),未達到其雙重主要試驗終點。默沙東並沒有提供具體數據,完整數據分析正在進行...
基因療法越來越貴!Orchard罕病基因療法定價425萬美元;BMS PD-1/CTLA-4抑制劑一線治療晚期肝癌臨床三期積極;思捷優達多重系統退化症新藥YA-101 臨床一期完成
2024-03-21 / 環球生技
《臺灣》思捷優達多重系統退化症新藥YA-101臨床一期完成今(21)日,台灣新藥公司思捷優達(YodaTherapeuticsInc.)宣布,旗下創新小分子化學新藥YA-101已於上月完成澳洲的一期臨床試驗的追蹤,目前進入數據分析階段。思捷優達計畫於今年第二季分別向台灣食藥署(TFDA)、美國食品藥物管理局(FDA)遞交YA-101治療多重系統退化症病患的臨床二期申請,並展開二期臨床試驗。YA-1...
BMS、MSD、Seagen大廠臨床數據出爐! PD-1抑制劑、ADC藥強攻膀胱癌、子宮頸癌
2023-10-23 / 記者 李林璦
10月20~24日,2023歐洲腫瘤醫學年會(EuropeanSocietyforMedicalOncology,ESMO)盛大舉行,必治妥施貴寶(BristolMyersSquibb,BMS)、默沙東(MSD)、被輝瑞(Pfizer)併購的Seagen等多家大藥廠發表臨床試驗數據。BMS的明星藥物PD-1抑制劑Opdivo與化療聯用,可降膀胱癌22%的死亡風險;而MSD的PD-1抑制劑Keytr...