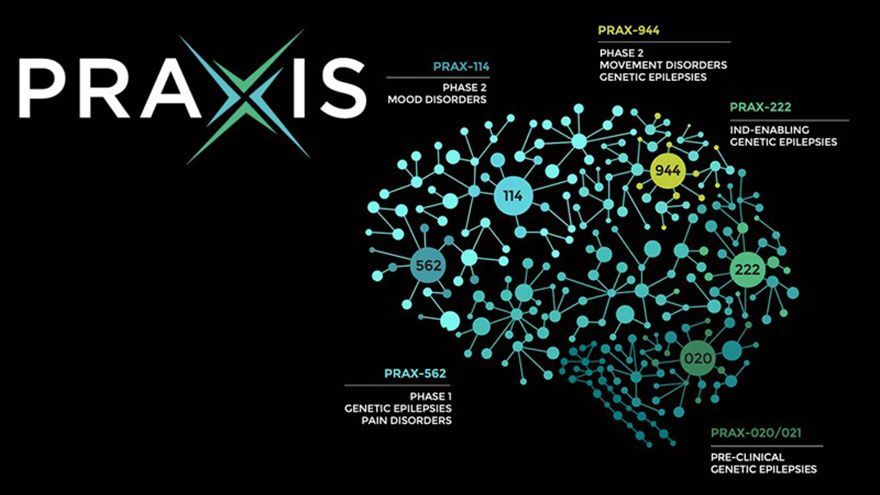
Praxis癲癇臨床二期提前結束!relutrigine療效亮眼將與FDA洽談
2025-12-08 / 記者 吳康瑋
美國時間5日,專注中樞神經療法開發的PraxisPrecisionMedicines宣布,旗下癲癇候選藥物relutrigine在臨床二期試驗EMBOLD中展現顯著療效,經獨立資料監測委員會建議提前結束收案。該試驗鎖定因SCN8A與SCN2A基因突變引起的發育性癲癇腦病變(developmentalandepilepticencephalopathies,DEE)患者,原訂2026年3月23日完成...
長庚醫院打造代謝、蛋白質體學雙核心研究平台
2025-10-09 / 新聞中心
長庚紀念醫院今(9)日宣布整合「臨床代謝體學核心實驗室」與「臨床蛋白質體核心實驗室」,打造亞洲少見的「雙核心研究平台」。新平台將導入人工智慧(AI)技術,結合高維度生物資料與臨床資訊,進行疾病分類、風險預測與個人化治療模型建構,為精準醫療與智慧醫療提供強力後盾。臨床蛋白質體核心實驗室:蛋白質體研究重鎮林口長庚醫院臨床代謝體學暨蛋白質體核心實驗室主任邱志勇醫師表示,蛋白質是生物體中執行細胞功能的關鍵...
藥華藥TCR-T細胞療法申請臨床一期試驗
2024-11-04 / 記者 李林璦
日前(2日),藥華藥(6446)公告,已向衛生福利部食品藥物管理署(TFDA)申請進行T細胞受體-T細胞(TCR-T)免疫療法TCRT-ESO-A2-TW用於治療末期實體腫瘤患者的臨床一期試驗,跨足細胞療法領域。 TCRT-ESO-A2-TW是一種以實體腫瘤為標靶的自體TCR-T細胞免疫療法,靶向HLA-A*02:01及NY-ESO-1均為陽性的患者。在2024年美國臨床腫瘤學會(ASCO)年會中...
Sarepta DMD基因療法有望完全批准?FDA擬6月決定
2024-02-19 / 記者 吳培安
全球基因療法將邁進大步?美國時間16日,SareptaTherapeutics宣布美國食品藥物管理局(FDA)已受理生物製劑藥證申請(BLA)之功效性補充(efficacysupplement),將審核其開發的裘馨氏肌肉失養症(DMD)基因療法Elevidys,是否可從加速批准轉變成一般性的完全批准(fullapproval),並將適用對象擴展到更多的DMD患者。 此項申請案結果,將攸關是否能取消...
Sarepta新一代DMD療法臨床二期數據積極
2024-01-30 / 記者 李林璦
美國時間29日,SareptaTherapeutics公布,其開發治療裘馨氏肌肉失養症(DMD)的下一代療法SRP-5051臨床二期數據,顯示該療法可顯著增加患者肌營養不良蛋白(dystrophin)表現量以及外顯子跳躍(exonskipper),與Sarepta在2016年獲批准的Exondys51(eteplirsen)相比,肌營養不良蛋白表現量是Exondys51的12.2倍,外顯子跳躍增加...
中裕新藥愛滋新藥肌肉注射劑型 臨床三期試驗數據出爐
2023-10-13 / 記者 李林璦
今(13)日,中裕新藥(4147)宣布,其愛滋病新藥Trogarzo肌肉注射(IM)劑型臨床三期試驗數據,研究顯示IM與靜脈推注(IVPush)在HIV患者體內平均最低濃度相似,且患者在IM試驗期間的病毒量抑制均維持。中裕表示,目前已經與加拿大Theratechnologies簽訂為期12年的愛滋病新藥Trogarzo北美獨家銷售行銷契約,將正式向美國食品藥物管理局(FDA)申請TrogarzoI...