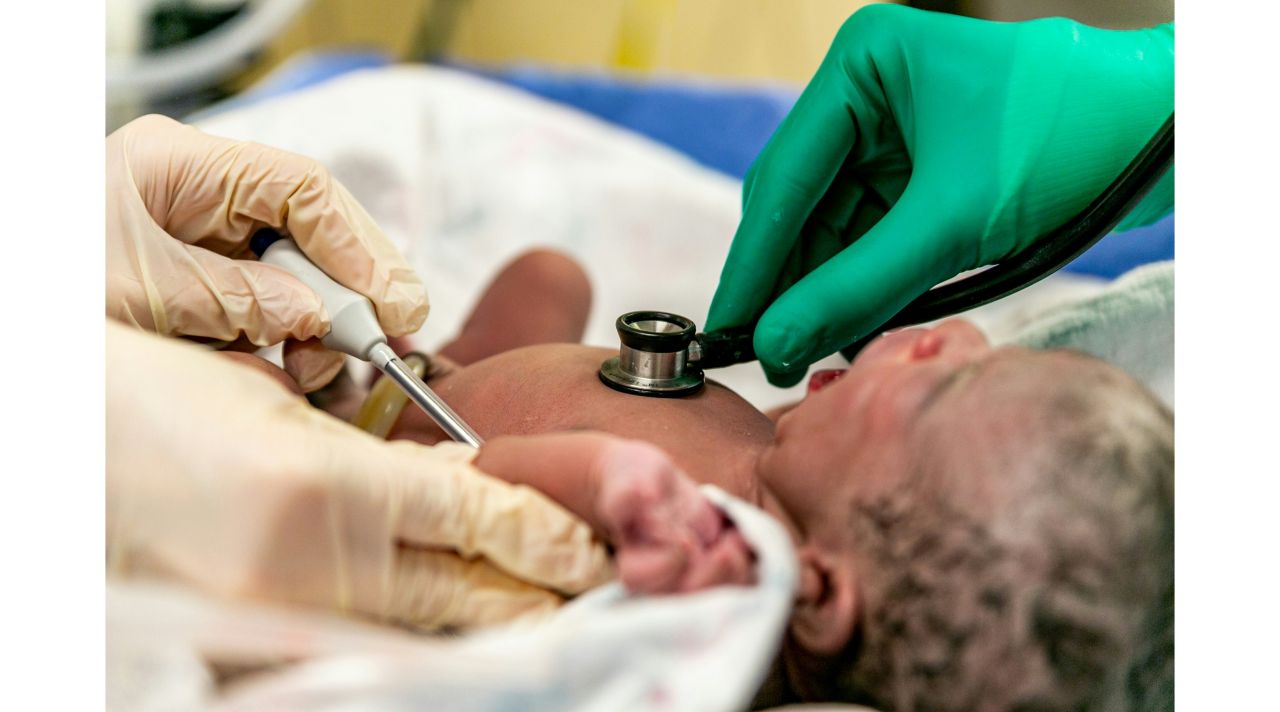
《JCI》揭新生兒罕見糖尿病新變異基因 TMEM167A牽動代謝、神經異常
2026-01-16 / 記者 高佳樺
美國時間14日,英國艾希特大學醫學院與比利時布魯塞爾自由大學合作研究,透過DNA定序技術結合幹細胞衍生的胰臟β細胞模型,首次揭示TMEM167A基因隱性變異與罕見新生兒糖尿病的關聯。研究指出,該變異除可導致新生兒糖尿病外,也可能合併小頭症與癲癇等神經學表現,但目前病例數仍有限,後續仍待更多研究釐清。這項研究發表於學術期刊《TheJournalofClinicalInvestigation...
FDA批准首款孟克斯氏症療法!罕見銅運輸缺陷迎突破
2026-01-15 / 記者 彭梓涵
近(13)日,美國食品藥物管理局(FDA)宣布批准美國罕病藥物公司SentynlTherapeutics,開發治療遺傳性銅缺乏症——孟克斯氏症候群(Menkesdisease)藥物Zycubo上市。該療法先前曾因為製造問題,在去年9月被FDA拒絕上市申請,如今在補齊相關缺失後順利過關,也成為該疾病首個治療藥物。Zycubo是一種銅替代療法,以每日皮下注射方式給藥,其活性成分...
思捷優達YA-101獲日本孤兒藥認定
2025-12-23 / 新聞中心
今(23)日,思捷優達-KY(7829)宣布旗下新藥YA-101,繼昨日公告獲美國FDA快速審查認定後,又獲得日本厚生勞動省認定為治療多重系統退化症(MSA)的孤兒藥,落實全球化開發戰略的實質進展。思捷優達表示,日本孤兒藥資格認證適用於日本國內患者數少於5萬、臨床需求高且具開發可行性的新藥。獲認定後,YA-101將可享日本再審查期最長延長至10年等優惠措施,並有助保障未來上市後的市場獨占性。由於學...
思捷優達YA-101獲美FDA授予治療多重系統退化症快速審查認定
2025-12-22 / 新聞中心
今(22)日,思捷優達-KY(7829)公告旗下子公司用於治療多重系統退化症(MSA)新藥YA-101,接獲美國食品藥物管理局(FDA)通知已通過審查,授與新藥「快速審查認定」(FastTrackDesignation)。思捷優達表示,這項快速審查認定可使目前進行中的YA-101臨床二期試驗於未來完成並彙整結果後,得與FDA進行更頻繁之諮詢會議及書面溝通,更及時取得FDA對後續臨床試驗設計及開發規...
安成生邁關鍵兩年!臨床解盲、授權齊發 目標2027年底登上市櫃
2025-09-23 / 記者 李林璦
今(23)日,安成生技(6610)表示,旗下產後憂鬱症口服療法NORA520已完成美國臨床二期試驗收案,預計今年第四季解盲,同時正在尋找授權夥伴,治療泡泡龍症(EBS)的AC203正在進行臨床二/三期試驗,目標明年第一季進期中分析,同時也正在尋找授權夥伴,目前已與2家國際藥廠接觸中。安成生技董事長吳怡君表示,2026年將進入授權高峰期,只要有任何一項核心資產完成全球授權,安成就有望於2027年底上...
FDA公布罕病審查新框架!單臂試驗可納入 臺灣生技能否受惠?
2025-09-05 / 記者 彭梓涵
罕見疾病藥物因享有美國食品藥物管理局(FDA)等機構的加速審查優勢,長期以來一直是臺灣中小型生技業者研發布局的首選。不過,近(4)日,美國FDA為了促進罕病治療藥物審批提議制定新流程,其中包括提供更具制度化、審查標準更明確的單臂試驗(single-arm)管道,但此措施僅適用於極少數超罕病族群,對臺灣業者而言究竟是利多還是挑戰,仍有待觀察並值得長期關注。 降低極小患者族群開發障礙 由於罕見疾病或...
FDA批准Jazz首款超罕見侵襲性腦瘤藥
2025-08-07 / 記者 彭梓涵
美國時間6日, JazzPharmaceuticals宣布,其開發用於治療H3K27M突變型瀰漫性中線膠質瘤(DMG)的市場首見(first-in-class)藥物Modeyso(dordaviprone),獲得美國食品藥物管理局(FDA)批准,用於1歲以上兒童與成人患者。此為FDA批准首款針對侵襲性腦癌的藥物,也是Jazz今年3月,以9.35億美元從Chimerix收購的重要成果。 此次批准是根...
陽明交大攜手臺大兒醫創FOXG1罕病預測新流程 準確率逾9成登國際期刊!
2025-06-30 / 記者 彭梓涵
今(30)日,陽明交通大學蔡金吾特聘教授與台大兒童醫院院長李旺祚醫師,分析14名來自世界各地FOXG1症候群患者的臨床症狀與腦部影像資料,建立一項結合實驗室功能檢測的創新流程。該流程整合蛋白表現分析、基因調控測試與小鼠胚胎細胞遷移實驗等,成功預測超過9成病患腦部異常的嚴重程度,有助早期診斷與治療介入,此研究已發表在《MolecularPsychiatry》。 蔡金吾表示,目前已有次世代基因定序(N...